

Inmaculada Soto Ortega
Jefe de Sección de Hemostasia y Trombosis
Hospital Universitario Central de Asturias
Profilaxis personalizada y empoderamiento del paciente. Cada paciente es único y necesita soluciones individualizadas adaptadas a sus necesidades.
“Tonight, I’m launching a new Precision Medicine Initiative to bring us closer to curing diseases like cancer and diabetes—and to give all of us access to the personalized information we need to keep ourselves and our families healthier.”
Barak Obama
Debate sobre el Estado de la Unión
20 enero 2015
La hemofilia (A o B) grave es el resultado de una deficiencia en un factor de coagulación (VIII (FVIII) o IX (FIX), respectivamente) y comporta un mayor riesgo de sangrado espontáneo y repetido en cualquier lugar del organismo, pero especialmente a nivel de las articulaciones y/o de los músculos. Las hemartrosis de repetición y la consecuente artropatía, representan una carga significativa para los pacientes, que reduce su calidad de vida y les ocasiona dolor crónico, absentismo escolar o laboral, movilidad reducida, necesidad ocasional de ayudas ortopédicas y, en muchos casos, cirugía ortopédica.1
1. Profilaxis
La administración de concentrados del factor deficitario en respuesta a un episodio hemorrágico (es decir, tratamiento episódico o a demanda) no modifica la historia natural de sangrado espontáneo y de complicaciones relacionadas con el mismo y así, no debe considerarse una opción de tratamiento a largo plazo para la hemofilia grave.1,2
Hace casi 50 años en Suecia se observó que los pacientes con hemofilia moderada rara vez experimentaban hemorragias articulares espontáneas y artropatía. Así, postularon que mantener los niveles de factor por encima de 1 UI/dL (1%) haría que la hemofilia grave presentase un fenotipo más moderado y reduciría sustancialmente el riesgo de sangrado articular. Esta teoría constituye la base de la profilaxis moderna en pacientes con hemofilia grave mediante terapia sustitutiva con el concentrado de factor deficitario y actualmente se considera el tratamiento óptimo para pacientes con hemofilia grave.1
La profilaxis se considera hoy el estándar de atención para las personas con hemofilia grave, y también para algunas con hemofilia moderada, o para aquellas con otro trastorno hemorrágico congénito asociado con un fenotipo hemorrágico severo y / o un alto riesgo de aparición de sangrado espontáneo potencialmente grave.
En 2020 la Federación Mundial de Hemofilia incluye dos novedades importantes en lo referentea la profilaxis:
-
una nueva definición de profilaxis como la administración regular de un agente o agentes hemostáticos con el objetivo de prevenir las hemorragias en personas con hemofilia, al tiempo que les permite llevar una vida activa y lograr una calidad de vida comparable a la de las personas sin hemofilia.
-
además, este mismo documento hace la consideración de que si bien en el pasado un nivel de factor mínimo de 1 UI / dL (1%) fue un objetivo adecuado, la mayoría de losmédicos actualmente prefieren alcanzar niveles mínimos más altos (>3% - 5%, o más) pues con ello se consigue reducir los sangrados. Esta es también una recomendación del Consenso Europeo para el tratamiento de la hemofilia que en concreto en su Recomendación 3 establece que, con terapias de vida media prolongada, se debería lograr un nivel mínimo del 3-5% para preservar la salud articular.3
Sin embargo, niveles mínimos más altos pueden requerir dosis más altas o infusiones más frecuentes de concentrados de factor de coagulación. Por lo tanto, esto debe personalizarse en función de las actividades, el estilo de vida y el manejo de la farmacocinética del factor.2
Los principales objetivos de la profilaxis en los pacientes con hemofilia grave son prevenir la hemorragia potencialmente mortal y el daño articular.
Se clasifica la profilaxis en función de la edad de inicio, el número de sangrados articulares y el estado de las articulaciones:
|
TIPO DE PROFILAXIS |
DEFINICIÓN |
|
profilaxis primaria |
es la que se inicia antes de los 3 años, antes del segundo hemartros y en ausencia de datos clínicos o radiográficos de enfermedad articular |
|
profilaxis secundaria |
cuando se inicia después de los 3 años, de dos o más hemorragias articulares, pero antes del inicio de la enfermedad articular |
|
profilaxis terciaria |
se inicia después el desarrollo de la enfermedad articular, generalmente en la edad adulta |
Tabla 1. Srivastava A., Santagostino E., Dougall A., Kitchen S., Sutherland M., Pipe S. W. et al. WFH Guidelines for the Management of Hemophilia, 3rd edition. Haemophilia 2020; 00: 1-158 2
Las opciones para diseñar un régimen de profilaxis incluyen protocolos estándar, dosificación basada en el fenotipo y un enfoque individualizado:
-
La dosificación tradicional o estándar se basa en el peso corporal (p. ej., 25 UI / kg tres días por semana) y se adapta a todos los pacientes.
-
La dosificación basada en el fenotipo es una estrategia de optimización del régimen de profilaxis en la que se usa el patrón de sangrado del paciente para adaptar la dosis, como un régimen de intensidad creciente desencadenado por episodios hemorrágicos.
-
Un enfoque individualizado, sin embargo, es más holístico y toma en consideración toda la información disponible sobre el paciente, incluyendo no solo su patrón fenotípico desangrado sino también el perfil farmacocinético (PK) del factor de reemplazo, el nivel de actividad física del sujeto y el riesgo percibido de hemorragia traumática, presencia o ausencia de enfermedad articular y cumplimiento del régimen posológico. Los regímenes de profilaxis personalizada de acuerdo con las características individuales del paciente pueden mejorar los resultados y ser rentables en los pacientes con hemofilia, por lo que las pautas de tratamiento de la hemofilia enfatizan la importancia de individualizar la profilaxis.
En general, la medicina personalizada es una estrategia de tratamiento en la que un medicamento o intervención terapéutica se combina con una herramienta de diagnóstico dirigida a la terapia en función de las características específicas del individuo. En el tratamiento de la hemofilia la individualización de la profilaxis no es un concepto nuevo. Cada paciente con hemofilia tiene un curso distinto de su enfermedad y un conjunto de factores de riesgo de hemorragia y artropatía que son únicos e individuales.
Algunos de los factores que contribuyen a la variabilidad observada entre pacientes incluyen actividad basal (residual) de FVIII / FIX, patrón de sangrado (fenotipo), estado articular, genotipo, perfil farmacocinético de FVIII o FIX, adherencia al tratamiento (incluidos los regímenes de profilaxis), la presencia de comorbilidades y el nivel de actividad física, incluido el riesgo por traumatismo.
El objetivo clave para lograr un resultado ortopédico favorable a largo plazo en pacientes con hemofilia es la reducción o eliminación de sangrado (es decir, tasa anualizada de sangrado articular [AJBR]).
1.1 Profilaxis individualizada
La evidencia creciente sugiere que las personas con hemofilia grave deben recibir una profilaxis personalizada en lugar de una dosis fija de profilaxis basada en el peso con objeto de maximizar la eficacia y flexibilidad del tratamiento y reducir su coste al mínimo.
La profilaxis personalizada se define como la individualización de la terapia de reemplazo de factor de acuerdo con las necesidades y expectativas del paciente y en función de su patrón de sangrado y farmacocinética personal.
Por definición, una profilaxis personalizada debe tener la suficiente flexibilidad como para permitir a los pacientes organizar sus propias vidas según sus necesidades y expectativas.4
La farmacocinética (PK)
El objetivo de la dosificación guiada por PK es individualizar los regímenes de profilaxis manteniendo niveles hemostáticamente adecuados de FVIII / FIX mediante la optimización de la dosis y el intervalo de dosificación del factor de coagulación de reemplazo.2
A pesar de la sólida evidencia favorable, lo complejo y laborioso del procedimiento que comportan los estudios farmacocinéticos clásicos (periodo de lavado, 11 determinaciones etc.), hicieron poco práctica la personalización de la profilaxis basada en PK y limitaron su uso hasta hace poco tiempo en que estos obstáculos se han podido superar gracias a la llamada farmacocinética poblacional (PopPK), basada en métodos de predicción bayesianos, que permite limitar las determinaciones analíticas a dos o tres muestras y que es flexible en cuanto al momento de la extracción. Este enfoque no precisa de la fase de lavado, potencialmente peligrosa, que requiere el enfoque tradicional y facilita la simulación de dosis y frecuencias necesarias para lograr los objetivos.4,5
La adherencia
La adherencia a los regímenes de profilaxis es otra característica específica del paciente que influye en los niveles plasmáticos y en el riesgo de hemorragia. Se define la adherencia como el porcentaje de infusiones dentro de un rango de dosis especificado (cumplimiento de la dosis) y el porcentaje de semanas sin dosis olvidadas (cumplimiento de la frecuencia).
Los desafíos clínicos y prácticos relacionados con la adherencia (Figura 1) pueden dificultar el conseguir una profilaxis óptima, en particular en adolescentes, y así, los regímenes de profilaxis deben individualizarse para abordar estos retos (Tabla 2). Los beneficios de la profilaxis son aplicables también a adultos con daño articular pre-existente y podrían resultar en menores consumos de concentrados de factor de reemplazo.
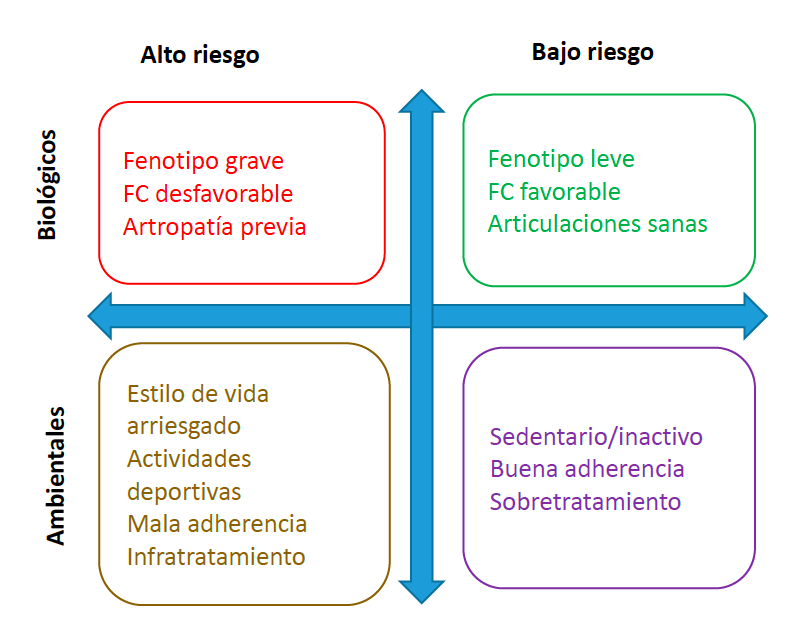
Figura 1: Factores determinantes del riesgo de sangrado y subsiguiente artropatía2

Tabla 2. Srivastava A., Santagostino E., Dougall A., Kitchen S., Sutherland M., Pipe S. W. et al. WFH Guidelines for the Management of Hemophilia, 3rd edition. Haemophilia 2020; 00: 1-1582
La actividad física
Cuando implica alto riesgo de impactos y/o se trata de actividades repetitivas, se asocia con un mayor riesgo de hemorragia, pero la aparición del sangrado a menudo es predecible y puede manejarse ajustando la dosis y / o el momento de la profilaxis en función de los patrones de actividad física del paciente.
La profilaxis individualizada sobre la base de la respuesta farmacocinética, el fenotipo hemorrágico y el estímulo de la adherencia son una opción viable tanto para niños como para adultos con hemofilia y daño articular pre-existente y deben valorarse en todos ellos, especialmente en aquellos con riesgo de padecer artropatía, dolor y movilidad reducida.2
Existen actualmente dispositivos y programas de software en curso que estiman la curva PK del paciente utilizando la farmacocinética poblacional y que permiten diseñar regímenes de dosificación personalizados para pacientes individuales en profilaxis. Tales herramientas están cambiando el concepto de profilaxis y permiten aumentar su eficacia, perfilando el tratamiento
según las necesidades reales del paciente y así mejorar su calidad de la vida proporcionando una flexibilidad razonable. Los resultados de los estudios que utilizan estas herramientas implican que mejoran el compromiso del paciente, garantizan el nivel adecuado de factor para un ejercicio seguro y ayudan a proporcionar un seguimiento adecuado de la atención clínica.
La personalización de la profilaxis debe considerarse un proceso dinámico que requiere un seguimiento y modificación continuos de acuerdo con las necesidades reales del individuo, inevitablemente requiere la participación activa del paciente en la conceptualización del programa de profilaxis y por tanto, el paciente debe convertirse en un miembro más del equipo de cuidados. El programa ideal debe tener en cuenta todos los aspectos médicos y sociales, así como los deseos y expectativas del paciente.4
Empoderamiento del paciente con hemofilia
La autogestión, es decir, la capacidad del paciente para acometer la gestión diaria de su salud y atención sanitaria, es fundamental en la hemofilia. Las personas con hemofilia deben ser competentes en cuanto controlar sus síntomas hemorrágicos con objeto de preservar su salud, la integridad de sus articulaciones y su independencia funcional. La autogestión les permite minimizar las consecuencias a corto y largo plazo del trastorno y puede ayudarles a proporcionar una sensación de normalidad y control.
Los componentes clave del autocuidado en la hemofilia incluyen:
reconocimiento de sangrado
- capacidad de auto infusión/auto tratamiento de los CFC (Concentrados de Factores deCoagulación) y otros medicamentos hemostáticos
- autocuidado: nutrición y forma física
- gestión del tratamiento: es decir, mantenimiento de registros, rutinas de tratamiento, mantenimiento adecuado del suministro del tratamiento, almacenamiento correcto, reconstitución y administración de medicamentos de tratamiento, registros de hemorragias y tratamientos
- manejo del dolor
- gestión de riesgos y asunción del concepto de terapia preventiva
- participación en la presentación de informes y la documentación de resultados
Las organizaciones de defensa de los pacientes históricamente han desempeñado un papel importante en el progreso en la atención de la hemofilia en todo el mundo, por lo tanto, también les corresponde alentar y apoyar la cobertura de aquellos aspectos de la atención que no estén cubiertos por el sistema sanitario, con especial interés en el empoderamiento del paciente y el trabajo con otros agentes sociales para promover la atención.
En el autocuidado es importante también el conocimiento y manejo de las terapias adyuvantes como analgésicos y antifibrinolíticos, así como los principios PRICE (Protect, Rest, Ice, Compression, Elevation).
En este sentido, las últimas Guías para el manejo de la Hemofilia de la WHF (Federación Mundial de Hemofilia) establecen en su recomendación 2.5.1 que los pacientes con hemofilia (o cuidadores de pacientes menores de edad o incapacitados) deberían recibir formación acerca del manejo de su cuidado en el hogar, así como ser capaces de reconocer las hemorragias e infundir (oautoinfundirse) el CFC correspondiente, con control y seguimiento de su capacidad de accesovenoso y eso debe ser así a lo largo de toda la vida del paciente.2
La introducción de la terapia domiciliaria ha permitido a los pacientes y a sus familias manejar la enfermedad de forma más independiente; sin embargo, el autocuidado en la hemofilia es exigente y complejo, incluyendo el reconocimiento del sangrado, el cumplimiento de la autoadministración de infusiones profilácticas, el registro de eventos hemorrágicos y el manejo de un inventario domiciliario de los medicamentos, lo que hace necesario el establecimiento de estrategias que mejoren tanto la autoeficacia de los pacientes con hemofilia como los resultados en salud. Para abordar estas necesidades, se han implementado plataformas que involucran diferentes tipos de tecnología para promover la educación y protección de la salud.
El término “telemedicina” o “tele-salud” puede definirse como el conjunto de intervenciones que utilizan la tecnología de las telecomunicaciones para facilitar la prestación remota de servicios de atención médica e información clínica.
Estas intervenciones pueden ser sincrónicas o asincrónicas e incluyen cualquier estrategia basada en tecnología de la información y la comunicación (las llamadas “TICs”) para conectar a los profesionales de la salud y a los pacientes a través de videoconferencias, correo electrónico, equipos de monitorización electrónica remoto, aplicaciones de redes sociales y portales de Internet. Por naturaleza, las intervenciones de tele-salud incluyen servicios de telemedicina interactivos que facilitan las interacciones concurrentes entre pacientes, cuidadores y médicos, y la monitorización remota del estado de salud de los pacientes mediante equipos de tele-salud y "telemedicina de almacenamiento y envío", que implica la transmisión de datos relacionados con la enfermedad, como imágenes médicas, hemorragias, incidencias y datos biológicos.
El uso de intervenciones innovadoras proporcionadas por herramientas de “tele-salud”, como las redes sociales y las aplicaciones tanto móviles como basadas en la web, pueden ayudar a monitorizar los eventos hemorrágicos y promover el uso apropiado de concentrados de factores de coagulación, mejorando así la adherencia de los pacientes al uso de la medicación y promoviendo así la independencia en el manejo de la enfermedad, entre los pacientes con hemofilia.
Entre las aplicaciones de tele-salud en la hemofilia se incluyen:
- Videoconferencia: permite interacción visual y verbal entre los participantes, pero requiere equipos informáticos y conexiones potentes (banda ancha)
- Teléfonos móviles: los teléfonos móviles están muy difundidos y permiten informar de la enfermedad (fotografías, vídeos, textos, información verbal etc.), recordatorios del tratamiento, registro de datos por el usuario, identificación de efectos adversos relacionados con el tratamiento, apps (Figura 2) que permiten recopilar información sobre episodios hemorrágicos y transmitirla en tiempo real al centro de tratamiento de hemofilia correspondiente, redes sociales.
- “Wearables” inteligentes: permiten monitorizar la actividad física diaria, establecer objetivos de actividad física (pasos, km, calorías consumidas...etc.)
- Programas de dispensación domiciliara de la medicación (“Home delivery”): ahorran tiempo y visitas de paciente/familiares al hospital
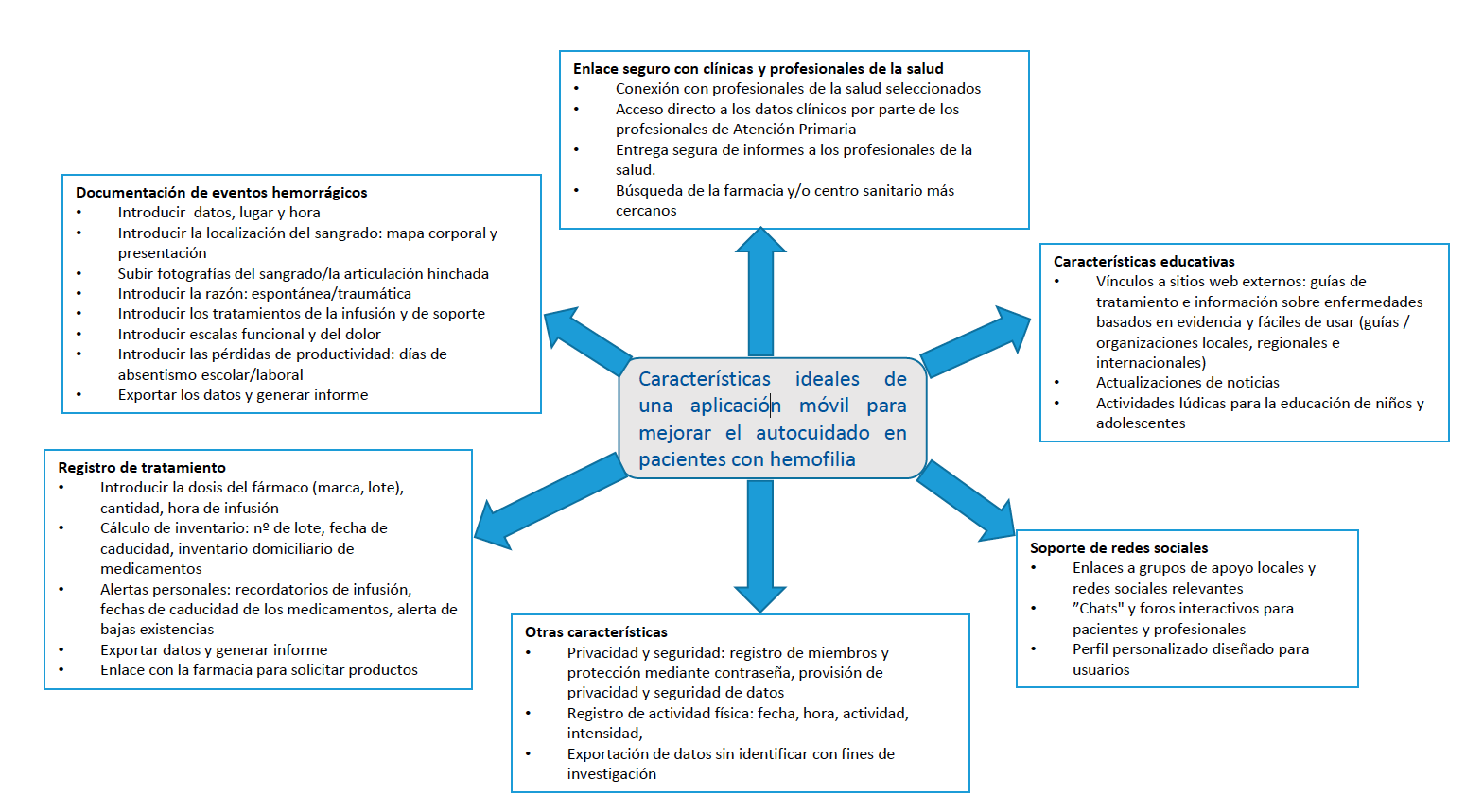
Figura 2: Características de la app ideal 5
Dada la complejidad y los recursos involucrados en el desarrollo de un sistema maduro y establecido, se requerirá una adecuada red de apoyo tecnológico y clínico.6
Por último, no se debe olvidar la importante función de las asociaciones de pacientes como medios para favorecer el aprendizaje y difundir los conocimientos y avances terapéuticos, así como para dar soporte individual y colectivo a la comunidad de pacientes con hemofilia.
BIBLIOGRAFÍA
- Petrini P., Valentino L. A., Gringeri A., Re W.M. and Ewestein B. Individualizing prophylaxisin hemophilia: a review. Expert Rev. Hematol. 2015; 8(2): 237–246
- Srivastava A., Santagostino E., Dougall A., Kitchen S., Sutherland M., Pipe S. W. et al. WFHGuidelines for the Management of Hemophilia, 3rd edition. Haemophilia 2020; 00: 1-158
- Peyvandi F., Berger K., Seitz R., Anneliese Hilger A., Hecquet M.L., Wierer M., et al. KreuthV initiative: European consensus proposals for treatment of hemophilia using standardproducts, extended half-life coagulation factor concentrates and non-replacementtherapies. Haematologica 2020; 105(8): 2038-2043
- Cem Ar M., Balsar Z. y Soysal T. Personalized prophylaxis in people with hemophilia Achallenges and achievements. Expert Review of Hematology. 2016; 9:12, 1203-1208
- Stemberger M., Kallenbach F., Schmit E., et al. Impact of Adopting PopulationPharmacokinetics for Tailoring Prophylaxis in Haemophilia A Patients: A HistoricallyControlled Observational Study. Thromb Haemost 2019; 119:368–376
- Qian W, Lam TT, Lam HHW, et al. Telehealth Interventions for Improving Self-Managementin Patients With Hemophilia: Scoping Review of Clinical Studies. J Med Internet Res. 2019;21: e12340
C-ANPROM/ES/HG/0088 Junio 2021
